Jenis reaksi
Ada reaksi yang dapat berlangsung satu arah ada yang dua arah.
Reaksi dinitrogen tetroksida dan nitrogen dioksida adalah salah satu reaksi yang dapat terjadi 2 arah.
Yang terjadi ketika reaksi:
Ketika N2O4 belum banyak yang terurai, campuran masih tidak berwarna yang menunjukkan jumlah NO2 yang dihasilkan masih sedikit. Reaksi akan terus berlangsung dan akan semakin banyak NO2 yang dihasilkan sampai menuju kesetimbangn. Pada saat ini konsentrasi NO2 dan N2O3 tidak berubah dan reaksi berlangsung 2 arah.
Ketika sistem mencapai kesetimbagan maka konstanta laju reaksi sebelum dan sesudah reaksi sama. (Kfwd dan Krev). Perbandingan konstanta laju reaksi juga sebanding dengan perbandingan konsentarasi tiap senyawa dengan pangkat koefisiennya
Perbandingan di atas disebut konstanta keseimbangan (K). K menunjukkan seberapa banyak rekasi menghasilkan produk. Nilai k berbeda beda.
Nilai K yang kecil menunjukkan reaksi belum berlangsung dengan sempurna, K besar berarti hampir seimbang dan K yang sama berarti rekasi dalam kesetimbangan .
Hasil bagi reaksi (Q)
Hasil bagi reaksi berhubungan dengan jumlah produk dan reaktan dalam reaksi kimia pada suatu titik waktu tertentu. Jika hasil reaksi dapat dibandingkan dengan K untuk memprediksi arah reaksi kimia terhadap kesetimbangan.
Contohnya pada reaksi:
Maka hubungan Q dan K seperti pada gambar:
Jika terdapat reaksi:
Perbandingan Qc dan Kc
- Qc = Kc , reaksi telah mencapai kesetimbangan. Jika Qc = Kc, reaktan ⇌ produk
- Qc < Kc , reaksi akan berlangsung dari arah kiri ke kanan (pembentukan produk) hingga mencapai kesetimbangan kimia (Qc = Kc). Jika Qc < Kc, reaktan → produk
- Qc > Kc , reaksi akan berlangsung dari arah kanan ke kiri (pembentukan reaktan) hingga mencapai kesetimbangan kimia (Qc = Kc). Jika Qc > Kc, reaktan ← produk
Perhitungan yang melibatkan Q dan K, ringkasnya :
Selain Kc, ada juga konsentrasi kesetimbagang berdasar tekanan (Kp). Hubungan Konstanta kesetimbangan berdasar konsentrasi (Kc) dan Konstanta kesetimbangan berdasar Tekanan (Kp)
Perhitungan hasil bagi reaksi gas NO2 menjadi NO dan O2:
Asas Le Chatelier
Adalah asas kesetimbangan yang terjadi dalam reaksi kesetimbangan seperti di bawah ini:
Contohnya:
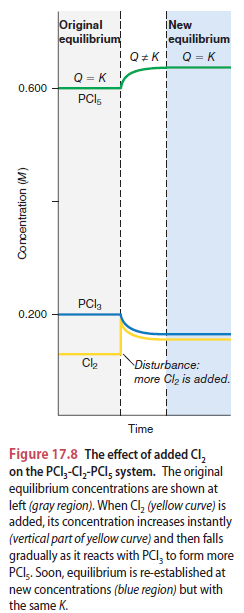
Pada grafik:
Visualisasi perubahan tekanan dan volume:
Perubahan temperatur
Reaksi ke arah PCl5 mengeluarkan kalor (Hrxn negatif- reaksi eksoterm)
Perubahan Konsentrasi, tekanan atau Volume, perubahan suhu, dan Pengaruh Katalis secara ringkas dapat dilihat pada tabel ini:
Van
Hoff Equation- Perubahan T dan hubungannya dengan K:
Untuk reaksi endoterm, penambahan temperatur akan menyebabkan reaksi bergeser ke kanan dan K akan bertambah. Untuk reaksi eksoterm terjadi sebaliknya.
- https://www.studiobelajar.com/kesetimbangan-kimia/
- https://kimia2018.wordpress.com/kimia-kelas-xi/semester-i/bab-4-kesetimbangan/
Latihan soal:
- https://tanya-tanya.com/contoh-soal-dan-pembahasan-reaksi-kesetimbangan/






















Mantap artikelnya bro / sis..kimia menurut saya salah satu mata pelajaran yang susah selain matematika..otak suka mendadak nge hank kalau disuruh mikir rumus"..:D
BalasHapusbtw tips diatas bisa menjadi rekomendasi yang mencari rumus kimia SMA kelas 11..