Lintasan Energi Pada Atom
Ikatan ion terjadi antara unsur yang memiliki kelebihan elektron bergabung dengan unsur yang membutuhkan elektron. Setiap unsur memiliki kecenderungan memiliki lintasan energi yang stabil sepeti gas mulia dalam golongan 8A (lihat tabel periodik). Lintasan energi tiap kulit akan terisi dengan aturan Oktet dengan jumlah elektron pada kulit terluar adalah 8 (kecuali Helium).
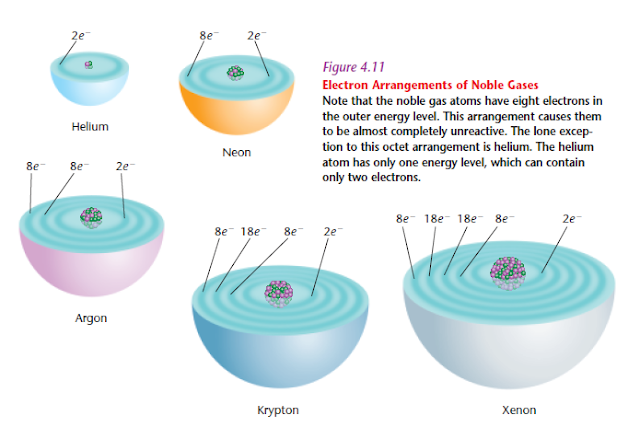 |
| Lintasan energi pada golongan 8 A yang stabil |
Misalnya unsur Na (sodium atau natrium) dengan nomor atom 11, memiliki kelebihan 1 elektron pada lintasan energi terluarnya (kulit). Kelebihan 1 elektron pada kulit terluar ini embuat Na dan unsur lain dalam golongan 1A sangat reaktif. Sementara Cl yang masuk dalam golongan VII A dengan nomor atom 17 membutuhkan 1 elektron untuk membuat lintasan energinya menjadi stabil. Pengabungan antara Na dan Cl membuat senyawa NaCl memiliki lintasan energi yang stabil.
Ikatan Ion Berdasar Asas AufBau
Asas Aufbau terutama berlaku untuk 18 atom pertama dan mulai tidak konsisten pada atom berikutnya dan juga pada logam transisi.
Kita dapat menggambarkan atom memiliki beberapa lintasan yang dapat disebut sebagai 'kulit'.
Ada beberapa jenis 'kulit' yang dapat terisi beberapa orbital yaitu s, p, d, f. Jumlah maksimum tiap kulit adalah:
s= 2 (n= 1. jumlah orbital = 2n² = 2)
p= 6 (n= 2. jumlah orbital = 2n² = 8, terdiri dari 2 orbital s dan 6 orbital p )
d= 10 ( n= 3. jumlah orbital = 2n² = 18, terdiri dari 2 orbital s, 6 orbital p dan 10 orbital d )
f= 14 (n= 4. jumlah orbital = 2n² = 32, terdiri dari 2 orbital s, 6 orbital p dan 14 orbital f )
Urutan mengisi kulit adalah:
 |
| https://id.wikipedia.org/wiki/Konfigurasi_elektron#/media/Berkas:Electron_orbitals.svg |
Kita dapat melihat bahwa nomor atom yang terletak di bawah kanan dengan pola: 2,4,10,12, 18 ... adalah nomor atom gas ideal yang kulitnya sudah terisi penuh. Untuk atom golongan lain, kemungkinan ada beberapa kulit yang tidak terisi.
Contohnya kulit terluar Na (3s) hanya terisi 1 elektron sementara pada Cl, kulit terluar (3p) juga terisi 1 elektron. Maka ketika Na memberikan 1 elektron pada Cl, kulit terluar Cl akan memenuhi akturan oktet (3s dan 3 p terisi 8 elektron).
Bentuk Senyawa Ion
Senyawa ion NaCl ini membentuk kristal ion dalam bentuk kubus dan memiliki sifat yang berbeda dari unsur Na dan Cl. Natrium sangat reaktif, berbentuk padat bereaksi dengan gas Chlorin akan membentuk senyawa Na Cl yang sifatnya sangat berbeda dari unsur pembentuknya.
NaCl memiliki ikatan ion yang sangat kuat dan susah untuk dipisahkan, sifatnya keras dan getas. Hal ini dapat dilihat dari kristal NaCl. Setiap ion positif akan dikelilingi dengan ion negatif, begitu juga sebaliknya.
Bentuk kristal NaCl solid pada suhu ruang, memiliki titik leleh yang cukup tinggi (di atas 800C).
Secara umum ikatan ion yang kuat dalam bentuk solid cenderung membuat senyawa menjadi tidak konduktif karena elektron sudah tidak dapat bergerak. Berbeda ketika senyawa berubah menjadi bentuk cair atau gas, akan ada sifat konduktivitas dan dapat berfungsi menjadi larutan elektrolit yang dapat menghantar listrik.
Sumber lain:





Tidak ada komentar:
Posting Komentar